Serviços CDMO para vetores lentivirais - Grau de Ind
Serviços
| Grau de Ind | 1 | Desenvolvido independentemente quatro - sistema plasmídico |
● Terceira geração quatro - sistema plasmídico ● Kanamicina - Gene de resistência ● conceder a licença, se necessário |
● A seguir, os padrões de submissão na China e nos EUA ● Workshop completo - GMP ● Área separada para criar bancos de células ● Workshops separados em áreas não estéreis e estéreis ● Sistema de gerenciamento da qualidade do GMP |
| 2 | Criação do banco de células GMP |
● Número personalizado de bancos celulares a serem criados ● Estudo de estabilidade do banco de células |
||
| 3 | Desenvolvimento de métodos de processo e teste |
● Os requisitos do projeto seguintes (sujeitos a alterações personalizadas) |
||
| 4 | Fabricação de GMP de vetores lentivirais |
● Processo de biorreator: 5 ~ 50 l Processo de biorreator descartável (sujeito a alterações personalizadas) ● Escala de produção: 2 ~ 30 L (sujeito a alterações personalizadas) |
||
| 5 | Teste de vetores lentivirais |
● Titer físico ● Titer infeccioso ● Titer funcional ● Teste de DNA de célula hospedeira residual 293T ● Teste residual de proteínas de células hospedeiras 293T ● Teste de DNA exógeno residual ● Teste de benzonase residual ● E1A/SV40 ● Teste de plasmídeo residual ● Tamanho do fragmento de DNA ● Virocines exógenos ● Esterilidade ● Mycoplasma ● Endotoxina |
||
| 6 | Validação do método |
● Especificidade ● Precisão ● Precisão ● Linearidade e alcance ● LOD |
||
| 7 | Estudo de estabilidade |
● Estabilidade longa - termo ● Estabilidade acelerada ● Teste de estresse |
Vantagens
| Vantagens de usar nossa plataforma para sérico - Cultura de suspensão livre de vetores lentivirais:
• Livre de componentes derivados de animais ao longo do processo • Produção linearmente ampliada de vetores lentivirais • Usando um único recipiente de um biorreator descartável de 50 l • Criação do banco de células em workshops separados • Dispensando produtos finais usando um isolador estéril • Sistema de lentivírus dedicado para células T - T, com alta eficiência de infecção • Baixos custos de produção e custos de teste (sem requisitos de teste para BSA e enzimas pancreáticas residuais) • Vários submissões de IND bem -sucedidas ao NMPA de vetores lentivirais para células T - |
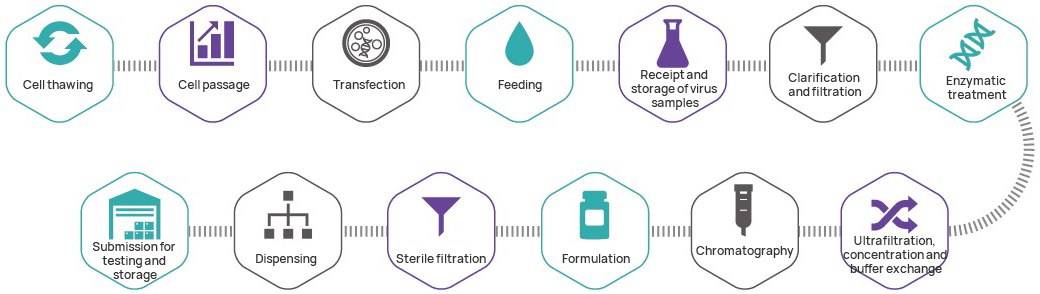
Processo de fabricação
Controle de qualidade
| Produto | Item de teste | Método de teste |
| Colheita de fluido | Contaminação adventícia de vírus | Método 3302 do CHP 2020 |
| Replicação - Lentivírus competente | Método de cultura de células indicadoras | |
| Substância de drogas/produto acabado | Aparência | Inspeção visual |
| Esterilidade | Método 1101 do CHP 2020 | |
| Mycoplasma |
Método 3301 do CHP 2020 |
|
| pH | Método 0631 do CHP 2020 | |
| Osmolalidade | Método 0632 do CHP 2020 | |
| Identificação da estrutura do gene alvo | Sequenciamento | |
| Proteína de célula hospedeira residual | Elisa | |
| Titer físico (P24) | Elisa | |
| Titer funcional | Citometria de fluxo | |
| Endotoxina | Método 1143 do CHP 2020 | |
| Benzonase residual | Elisa | |
| DNA de célula hospedeira residual | Q - PCR | |
| Transferência de genes residuais E1A | Método da cultura | |
| Transferência de genes residuais SV40 | Método da cultura |
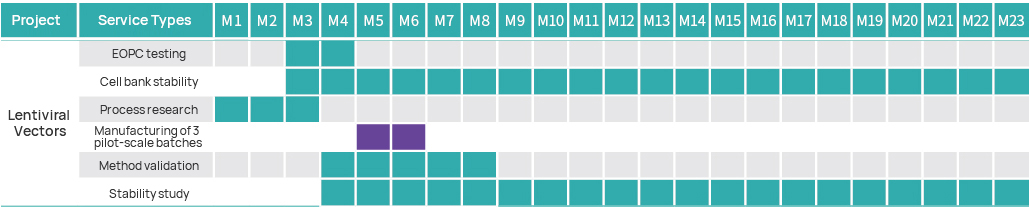
Linha do tempo do projeto
Plano de gerenciamento de projetos
A equipe de gerenciamento de projetos da Hillgene, composta por cientistas -chefe, gerentes de projeto, especialistas em QA e GMP, fará esforços para garantir a operação suave e sólida de todo e qualquer projeto GMP.













