CDMO -Dienste für Plasmide - Ind -Klasse
Dienstleistungen
| CDMO -Dienste für Plasmide | ||||
| Typen | Dienstleistungen | |||
| IND -Klasse | 1 | Unabhängig entwickelte vier - Plasmidsysteme |
● Die vierte Generation der dritten Generation - Plasmidsystem ● Kanamycin - Resistenzgen ● Bei Bedarf die Lizenz gewähren |
● Nach den Standards für die Einreichung sowohl in China als auch in den USA nach ● Voll - GMP Workshop ● Separate Bereich für die Erstellung von Zellbanken ● Separate Workshops in nicht - sterilen und sterilen Bereichen ● GMP -Qualitätsmanagementsystem |
| 2 | GMP -Schöpfung der Bakterienzellbank |
● Auswahl monoklonaler Antikörper ● MAINGEMALE Anzahl von Zellbanken, die erstellt werden sollen ● Zellbankstabilitätsstudie |
||
| 3 | Prozess- und Testmethodeentwicklung |
● Nach den Projektanforderungen (vorbehaltlich kundenspezifischer Änderungen) |
||
| 4 | GMP -Herstellung von Plasmiden |
● Produktionsleistung: 10 mg ~ 1 g (vorbehaltlich kundenspezifischer Änderungen) ● Fermentationsvolumen: 3 ~ 30 l (vorbehaltlich kundenspezifischer Änderungen) ● Reinigungsmethode: Drei - Schritt Ansatz/zwei - Schritt Ansatz |
||
| 5 | Plasmidtests |
● Reinheit (HPLC) ● Reste E. Coli -DNA -Tests ● Reste E. Coli HCP -Tests ● Reste E. Coli -RNA -Tests ● Rest -Antibiotika -Tests ● Sterilität ● Mycoplasma ● Endotoxin |
||
| 6 | Methodenvalidierung |
● Spezifität ● Genauigkeit ● Präzision ● Linearität und Bereich ● LOD |
||
| 7 | Stabilitätsstudie |
● Lange - Termstabilität ● Beschleunigte Stabilität ● Spannungstests |
||
Vorteile
| Vorteile unseres Plasmidsystems:
• Ein unabhängig entwickeltes vier - Plasmidsystem mit Kanamycin - Resistenzgen • Ein System mit der Fähigkeit einer anhaltenden Optimierung • Plasmidsequenzen sind nachvollziehbar, entsprechen den Anforderungen und effizient • Umfangreiche Erfahrungen in erfolgreichen IND -Einsendungen • Car - T -Zellproben für den klinischen Einsatz werden derzeit hergestellt und verwendet • 2 - 5fache höhere Titer nach der Verwendung unseres Plasmidsystems aus dem Vergleich in mehreren Projekten |
Vorteile unserer Plasmidherstellung: • Frei von Antibiotika während des gesamten Herstellungsprozesses • Plasmidproduktion und Bankerstellung in getrennten Workshops • Vollständige Isolation zwischen nicht - sterilen und sterilen Bereichen • Abgabe von Endprodukten mit einem Isolator • Fertig CTD -Dossiers für das Verpackungsplasmid (für lentivirale Vektor), wodurch die Vorbereitungszeit der Einreichung um 3 - 4 Monate verkürzt wird, wobei die INDS einiger Produkte vorläufige Zulassung und derzeit in Phase I der klinischen Studie erteilt wurden |
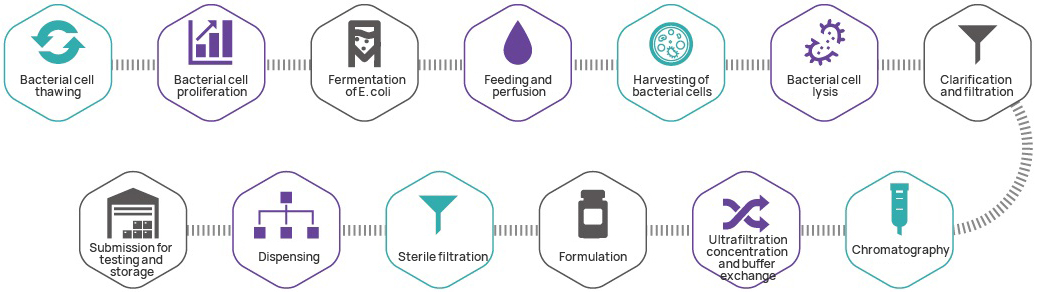
Herstellungsprozess
Qualitätskontrolle
| Testelement | Testmethode | |
| Aussehen | Visuelle Inspektion | |
| Identifikation | Identifizierung 1 | Restriktionskartierung |
| Identifizierung 2 | Sanger -Sequenzierung | |
| Prüfen | pH | Methode 0631 von CHP 2020 |
| Reinheit | Hochleistungsflüssigchromatographie (HPLC) | |
| Residual E. Coli Wirt Cell Protein | Elisa | |
| Reste E. Coli DNA | Q - PCR | |
| Reste E. Coli RNA | Q - PCR | |
|
Restantibiotika |
Elisa | |
| Endotoxin | Methode 1143 von CHP 2020 | |
| Sterilität | Methode 1101 von CHP 2020 | |
| Konzentrationsbestimmung | DNA -Konzentration | Methode 0401 von CHP 2020 |
Projektzeitleiste
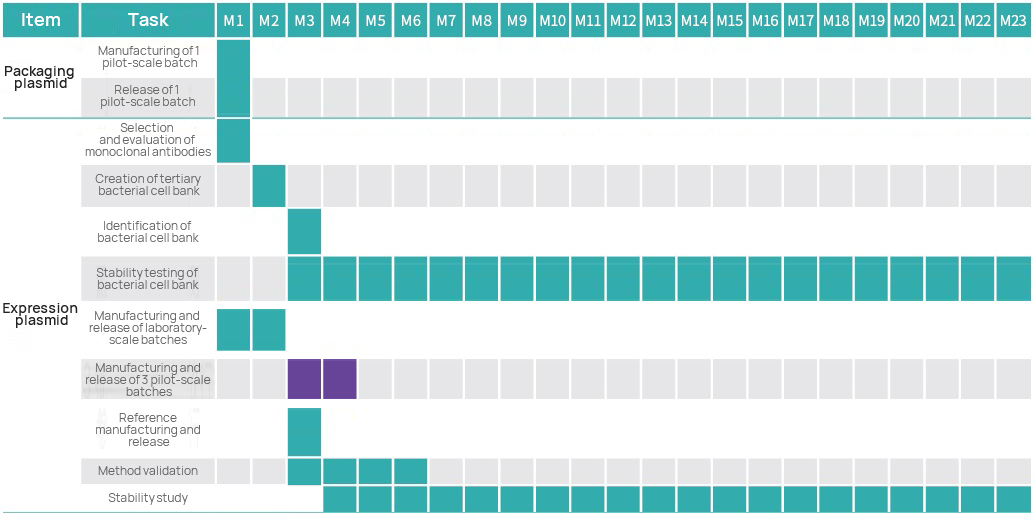
Projektmanagementplan
Das Hillgene -Projektmanagementteam, das aus Chefwissenschaftlern, Projektmanagern, Projekt -QA- und GMP -Experten besteht, wird sich bemühen, den reibungslosen und soliden Betrieb jedes GMP -Projekts zu gewährleisten.













