CDMO -Dienste für lentivirale Vektoren - IND -Klasse
Dienstleistungen
| IND -Klasse | 1 | Unabhängig entwickelte vier - Plasmidsysteme |
● Die vierte Generation der dritten Generation - Plasmidsystem ● Kanamycin - Resistenzgen ● Bei Bedarf die Lizenz gewähren |
● Nach den Standards für die Einreichung sowohl in China als auch in den USA nach ● Voll - GMP Workshop ● Separate Bereich für die Erstellung von Zellbanken ● Separate Workshops in nicht - sterilen und sterilen Bereichen ● GMP -Qualitätsmanagementsystem |
| 2 | Schaffung der GMP -Zellbank |
● MAINGEMALE Anzahl von Zellbanken, die erstellt werden sollen ● Zellbankstabilitätsstudie |
||
| 3 | Prozess- und Testmethodeentwicklung |
● Nach den Projektanforderungen (vorbehaltlich kundenspezifischer Änderungen) |
||
| 4 | GMP -Herstellung lentiviraler Vektoren |
● Bioreaktorprozess: 5 ~ 50 l Einwegbioreaktorprozess (vorbehaltlich kundenspezifischer Änderungen) ● Produktionsskala: 2 ~ 30 l (vorbehaltlich kundenspezifischer Änderungen) |
||
| 5 | Testen lentiviraler Vektoren |
● Physischer Titer ● Infektionstiter ● Funktionstiter ● Residual 293T Wirtszell -DNA -Tests ● Rest 293t Wirtszellprotein -Tests ● Reste exogene DNA -Tests ● Restbenzonase -Tests ● E1A/SV40 ● Restplasmidtests ● DNA -Fragmentgröße ● Exogene Virokine ● Sterilität ● Mycoplasma ● Endotoxin |
||
| 6 | Methodenvalidierung |
● Spezifität ● Genauigkeit ● Präzision ● Linearität und Bereich ● LOD |
||
| 7 | Stabilitätsstudie |
● Lange - Termstabilität ● Beschleunigte Stabilität ● Spannungstests |
Vorteile
| Vorteile der Nutzung unserer Plattform für Serum - freie Aufhängungskultivierung lentiviraler Vektoren:
• Frei von Tier - abgeleitete Komponenten während des gesamten Prozesses • Linear skalierte Produktion von lentiviralen Vektoren • Verwenden Sie einen einzelnen Behälter mit einem 50 -l -Einwegbioreaktor • Zellbankerstellung in getrennten Workshops • Abgabe von Endprodukten mit einem sterilen Isolator • Dediziertes Lentivirus -System für Auto -T -Zellen mit hoher Infektionseffizienz • Niedrige Produktionskosten und Testkosten (keine Testanforderungen für BSA und restliche Pankreasenzyme) • Mehrere erfolgreiche IND -Einreichungen bei NMPA von lentiviralen Vektoren für Car - T -Zellen |
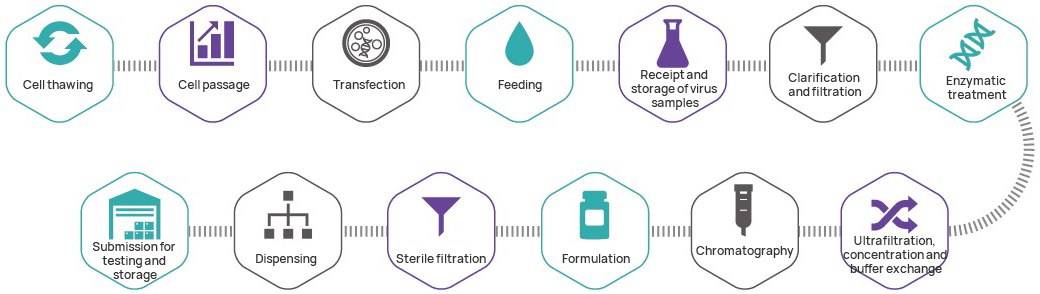
Herstellungsprozess
Qualitätskontrolle
| Produkt | Testelement | Testmethode |
| Ernteflüssigkeit | Adventitiver Viruskontamination | Methode 3302 von CHP 2020 |
| Replikation - kompetente Lentiviren | Indikatorzellkulturmethode | |
| Arzneimittelsubstanz/fertiges Produkt | Aussehen | Visuelle Inspektion |
| Sterilität | Methode 1101 von CHP 2020 | |
| Mycoplasma |
Methode 3301 von CHP 2020 |
|
| pH | Methode 0631 von CHP 2020 | |
| Osmolalität | Methode 0632 von CHP 2020 | |
| Identifizierung der Zielgenstruktur | Sequenzierung | |
| Restwirtszellprotein | Elisa | |
| Physischer Titer (P24) | Elisa | |
| Funktionstiter | Durchflusszytometrie | |
| Endotoxin | Methode 1143 von CHP 2020 | |
| Restbenzonase | Elisa | |
| Restwirtszellen -DNA | Q - PCR | |
| Reste E1A -Gentransfer | CO - Kulturmethode | |
| Reste SV40 -Gentransfer | CO - Kulturmethode |
Projektzeitleiste
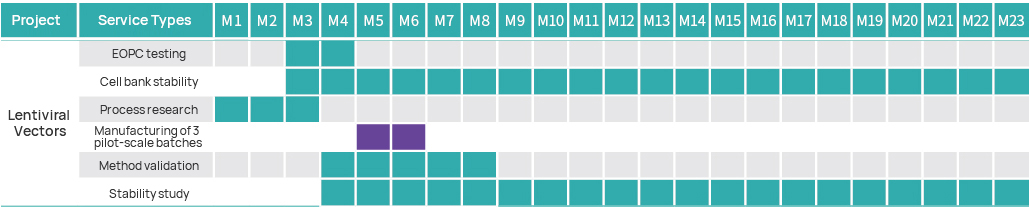
Projektmanagementplan
Das Hillgene -Projektmanagementteam, das aus Chefwissenschaftlern, Projektmanagern, Projekt -QA- und GMP -Experten besteht, wird sich bemühen, den reibungslosen und soliden Betrieb jedes GMP -Projekts zu gewährleisten.













