La necesidad de las pruebas de ADN residual de E.Coli
En campos como la terapia celular y génica, los plásmidos virales se amplifican y fermentan usando E. coli como huésped. El plásmido amplificado necesita someterse a un control de calidad de ADN residual de e.coli antes de que pueda usarse para infectar 293 células y empaquetar el virus. Por lo tanto, la detección del ADN residual de E. coli es crítica.
Requisitos reglamentarios y métodos de prueba
Las directrices actuales de la FDA de la OMS y EE. UU. Recomiendan el ADN residual en los productos terminados para no ser superiores a 10 ng/agente, y la FDA de los EE. UU. También establece que el ADN residual en las células huésped de Biologics no debe ser superior a 100 pg/agente. Los principios generales de la farmacopea europea estipulan que el límite del ADN residual en productos biológicos no debe ser mayor de 10 ng/dosis, pero el límite de ADN residual para algunas vacunas particular PG/dosis. La edición 2020 de la farmacopea china, la Parte III, estipula que el residuo de ADN en las preparaciones biológicas producidas en una matriz celular no debe exceder las 100 pg/dosis, y el residuo de ADN en las vacunas producidas en una matriz bacteriana u fungal no debe exceder las 10 ng/dosis.
Además, para los métodos de determinación de residuos de ADN exógeno, las farmacopeías nacionales también dan recomendaciones de guía. La edición de Farmacopeo de EE. UU. 2017 de la disposición general de USP40 - NF35 1130 describe tres métodos para la determinación de los residuos de ADN exógenos, que son la hibridación de la sonda de ADN, el método de umbral y el método de PCR cuantitativo real en el tiempo. La farmacopea europea propone PCR cuantitativa real y método inmunoenzimático, dos métodos analíticos sensibles para cuantificar el ADN residual de las células huésped. La versión china de farmacopeo 2020 de las tres reglas generales 3407 también estipula que los métodos de detección de residuos de ADN de células huésped son la hibridación de la sonda de ADN, la tinción de fluorescencia y la PCR cuantitativa.
Entre ellos, el método QPCR tiene una sensibilidad extremadamente alta, especificidad de secuencia y precisión, lo que puede proporcionar un medio confiable de detección para la industria biofarmacéutica en la investigación de procesos y el control de calidad de los productos terminados, y ahora se ha convertido en el método de detección preferido para cada fabricante biológico.
Información sobre los productos BlueKit
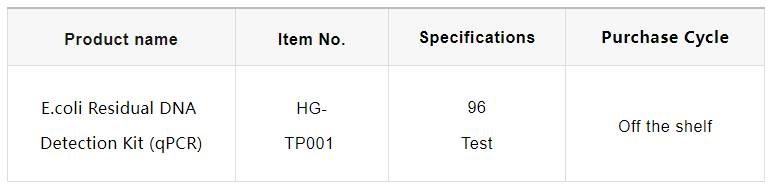
Características del producto
Detección rápida, fuerte especificidad, rendimiento confiable, el límite de detección más bajo puede alcanzar el nivel de "FG".
Parámetros del producto
- Rango de detección: 3.00 × 101 ~ 3.00 × 105fg/μl
- Límite de cuantificación:00 × 101FG/μL
- Límite de detección:00 FG/μL
- Precisión: CV% ≤ 15%.
Problemas y precauciones de detección comunes
1. Este kit es solo para uso de investigación in vitro, no para el diagnóstico clínico.
2. El kit debe usarse dentro del período de validez.
3. Se recomienda que todos los componentes del kit se derreten en un entorno de baja temperatura y luego se usen.
4. Solo cumple estrictamente con las instrucciones del método de operación, todo el uso de los reactivos de soporte del kit para garantizar el mejor efecto de detección.
5. Presta atención a los diferentes pasos de muestreo de manera oportuna para reemplazar la punta, para evitar la contaminación cruzada, evite abrir la tapa durante mucho tiempo.
6. Los resultados finales de la prueba pueden verse significativamente afectados por la efectividad de los reactivos, los métodos operativos del operador y el entorno de prueba.
Consulta de productos
Teléfono: +86 - 18013115357
Correo electrónico:info@hillgene.com
Tiempo de publicación: 2024 - 01 - 11 10:31:30











