Services CDMO pour les plasmides - Grade Ind
Services
| Services CDMO pour les plasmides | ||||
| Types | Services | |||
| Grade IND | 1 | Développé indépendamment quatre - système plasmidique |
● Troisième génération quatre - Système plasmidique ● Kanamycine - gène de résistance ● Accorder la licence, si nécessaire |
● Normes suivantes de soumission en Chine et aux États-Unis ● Full - atelier GMP ● Zone séparée pour créer des banques cellulaires ● Ateliers séparés dans les zones non stériles et stériles ● Système de gestion de la qualité GMP |
| 2 | Création BPF de la banque de cellules bactériennes |
● Sélection d'anticorps monoclonaux ● Nombre de banques de cellules sur mesure à créer ● Étude de stabilité de la banque cellulaire |
||
| 3 | Développement de méthode de processus et de test |
● Exigences suivantes du projet (sous réserve de modifications personnalisées) |
||
| 4 | Fabrication BPF de plasmides |
● Production de production: 10 mg ~ 1 g (sous réserve de modifications personnalisées) ● Volume de fermentation: 3 ~ 30 L (sous réserve de modifications personnalisées) ● Méthode de purification: trois - Approche étape / deux - Approche étape |
||
| 5 | Tests plasmidiques |
● Pureté (HPLC) ● Test résiduel de l'ADN e. coli ● Test résiduel E.Coli HCP ● Test résiduel de l'ARN e. coli ● Test des antibiotiques résiduels ● Stérilité ● Mycoplasma ● endotoxine |
||
| 6 | Validation de la méthode |
● Spécificité ● Précision ● précision ● Linearité et portée ● Lod |
||
| 7 | Étude de stabilité |
● Long - stabilité du terme ● Stabilité accélérée ● Test de contrainte |
||
Avantages
| Avantages de notre système plasmidique:
• Un système de quatre - plasmides développé indépendamment avec du gène de résistance à la kanamycine - • un système avec la capacité d'optimisation soutenue • Les séquences plasmidiques sont traçables, conformes aux exigences et efficaces • Expérience approfondie dans les soumissions IND réussies • Les échantillons de cellules To - T pour une utilisation clinique sont actuellement fabriqués et utilisés • 2 - 5 replie des titres plus élevés après avoir utilisé notre système plasmidique à partir de la comparaison dans plusieurs projets |
Avantages de notre fabrication du plasmide: • sans antibiotiques tout au long du processus de fabrication • Production du plasmide et création de banques dans des ateliers séparés • Isolement complet entre les zones non stériles et stériles • Disppensation des produits finaux à l'aide d'un isolateur • Dossiers CTD complétés pour le plasmide d'emballage (pour le vecteur lentiviral), réduisant le temps de préparation de la soumission de 3 - 4 mois, avec des Inds de quelques produits accordés à l'approbation préliminaire et actuellement en phase I de l'étude clinique |
Processus de fabrication
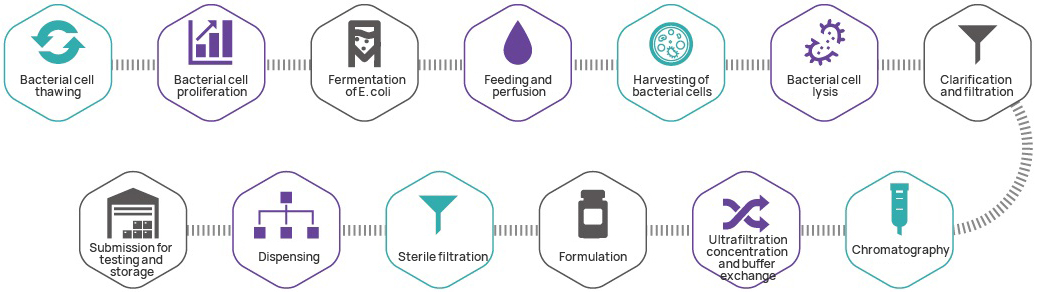
Contrôle de qualité
| Élément de test | Méthode d'essai | |
| Apparence | Inspection visuelle | |
| Identification | Identification 1 | Cartographie des restrictions |
| Identification 2 | Séquençage Sanger | |
| Test | pH | Méthode 0631 de CHP 2020 |
| Pureté | Chromatographie liquide haute performance (HPLC) | |
| Protéine de cellules hôtes résiduelles. | Elisa | |
| ADN d'e-coli résiduel | Q - PCR | |
| ARN d'e-coli résiduel | Q - PCR | |
|
Antibiotiques résiduels |
Elisa | |
| Endotoxine | Méthode 1143 de CHP 2020 | |
| Stérilité | Méthode 1101 de CHP 2020 | |
| Détermination de la concentration | Concentration d'ADN | Méthode 0401 de CHP 2020 |
Chronologie du projet
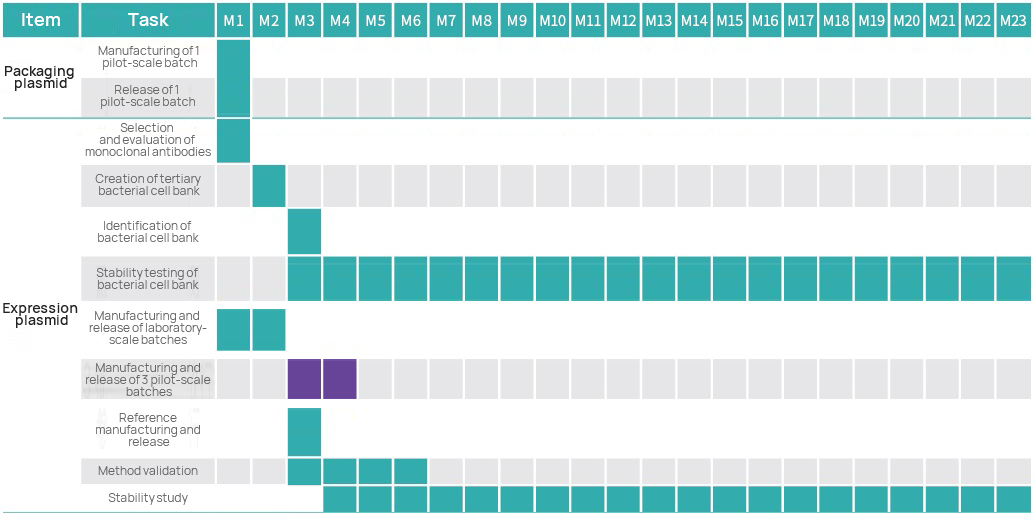
Plan de gestion de projet
L'équipe de gestion de projet de Hillgene, composée de scientifiques en chef, de chefs de projet, d'experts du projet QA et de GMP, fera des efforts pour assurer le fonctionnement fluide et solide de chaque projet BPF.













