Services CDMO pour les vecteurs lentiviraux - Grade IND
Services
| Grade IND | 1 | Développé indépendamment quatre - système plasmidique |
● Troisième génération quatre - Système plasmidique ● Kanamycine - gène de résistance ● Accorder la licence, si nécessaire |
● Normes suivantes de soumission en Chine et aux États-Unis ● Full - atelier GMP ● Zone séparée pour créer des banques cellulaires ● Ateliers séparés dans les zones non stériles et stériles ● Système de gestion de la qualité GMP |
| 2 | Création de la banque cellulaire GMP |
● Nombre de banques de cellules sur mesure à créer ● Étude de stabilité de la banque cellulaire |
||
| 3 | Développement de méthode de processus et de test |
● Exigences suivantes du projet (sous réserve de modifications personnalisées) |
||
| 4 | Fabrication GMP de vecteurs lentiviraux |
● Processus du bioréacteur: 5 ~ 50 L Processus de bioréacteur jetable (sous réserve de modifications personnalisées) ● Échelle de production: 2 ~ 30 L (sous réserve de modifications personnalisées) |
||
| 5 | Test des vecteurs lentiviraux |
● Titre physique ● Titre infectieux ● Titer fonctionnel ● Test de l'ADN des cellules hôtes résiduelles 293T ● Test de protéines de cellules hôtes résiduelles 293T ● Test résiduel d'ADN exogène ● Test résiduel de la benzonase ● E1A / SV40 ● Test de plasmide résiduel ● Taille des fragments d'ADN ● Virokines exogènes ● Stérilité ● Mycoplasma ● endotoxine |
||
| 6 | Validation de la méthode |
● Spécificité ● Précision ● précision ● Linearité et portée ● Lod |
||
| 7 | Étude de stabilité |
● Long - stabilité du terme ● Stabilité accélérée ● Test de contrainte |
Avantages
| Avantages de l'utilisation de notre plate-forme pour le sérum - Culture de suspension libre de vecteurs lentiviraux:
• Libéré des composants dérivés des animaux tout au long du processus • Production à l'échelle linéaire de vecteurs lentiviraux • Utilisation d'un seul conteneur d'un bioréacteur jetable de 50 L • Création de banque cellulaire dans des ateliers séparés • Disppensation des produits finaux à l'aide d'un isolateur stérile • Système de lentivirus dédié pour les cellules de voiture, avec une efficacité à haute infection • Faible coût de production et coûts de test (aucune exigence de test pour la BSA et les enzymes pancréatiques résiduelles) • Plusieurs soumissions d'Ind réussies à NMPA de vecteurs lentiviraux pour les cellules de la voiture |
Processus de fabrication
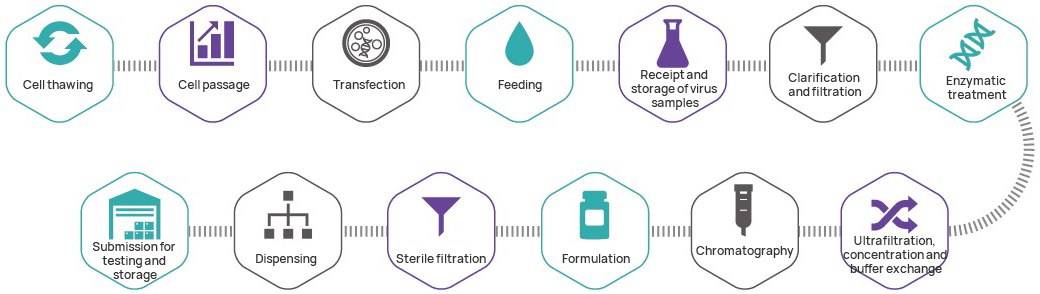
Contrôle de qualité
| Produit | Élément de test | Méthode d'essai |
| Récolte du liquide | Contamination du virus adventieux | Méthode 3302 de CHP 2020 |
| Réplication - lentivirus compétent | Méthode de culture cellulaire indicatrice | |
| Support de médicament / produit fini | Apparence | Inspection visuelle |
| Stérilité | Méthode 1101 de CHP 2020 | |
| Mycoplasme |
Méthode 3301 de CHP 2020 |
|
| pH | Méthode 0631 de CHP 2020 | |
| Osmolalité | Méthode 0632 de CHP 2020 | |
| Identification de la structure des gènes cible | Séquençage | |
| Protéine de cellules hôtes résiduelles | Elisa | |
| Titre physique (P24) | Elisa | |
| Titre fonctionnel | Cytométrie en flux | |
| Endotoxine | Méthode 1143 de CHP 2020 | |
| Benzonase résiduelle | Elisa | |
| ADN de cellules hôtes résiduelles | Q - PCR | |
| Transfert de gènes résiduel E1A | CO - Méthode de culture | |
| Transfert de gène résiduel SV40 | CO - Méthode de culture |
Chronologie du projet
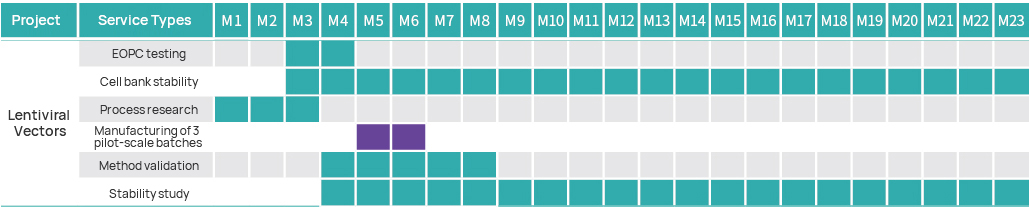
Plan de gestion de projet
L'équipe de gestion de projet de Hillgene, composée de scientifiques en chef, de chefs de projet, d'experts du projet QA et de GMP, fera des efforts pour assurer le fonctionnement fluide et solide de chaque projet BPF.













