Usługi CDMO dla plazmidów - klasy IND
Usługi
| Usługi CDMO dla plazmidów | ||||
| Typy | Usługi | |||
| IND | 1 | Niezależnie opracowany czterech - plazmid system |
● System plazmidu trzeciej generacji cztery ● Gen kanamycyny - Oporność ● Przyznanie licencji, w razie potrzeby |
● Postępowanie zgodnie ze standardami zgłoszenia zarówno w Chinach, jak i USA ● Pełne - warsztat GMP ● Oddzielny obszar do tworzenia banków komórkowych ● Oddzielne warsztaty w obszarach nietymialnych i sterylnych ● System zarządzania jakością GMP |
| 2 | GMP tworzenie bakteryjnego banku komórek |
● Wybór przeciwciał monoklonalnych ● Tailowa liczba banków komórkowych do utworzenia ● Badanie stabilności banku komórkowego |
||
| 3 | Rozwój metod procesowych i testowych |
● Postępowanie zgodnie z wymogami projektu (w zależności od dostosowanych zmian) |
||
| 4 | GMP Produkcja plazmidów |
● Wyjście produkcyjne: 10 mg ~ 1 g (z zastrzeżeniem dostosowanych zmian) ● Objętość fermentacji: 3 ~ 30 l (z zastrzeżeniem dostosowanych zmian) ● Metoda oczyszczania: Trzy - Podejście do kroku/Dwa - Podejście krokowe |
||
| 5 | Testowanie plazmidu |
● Czystość (HPLC) ● Resztkowe testowanie DNA E.Coli ● Resztkowe testy HCP E.Coli ● Resztkowe testowanie RNA E.Coli ● Testy resztkowe antybiotyki ● Sterylizacja ● Mycoplasma ● Endotoksyna |
||
| 6 | Walidacja metody |
● Specyficzność ● Dokładność ● Precyzja ● Liniowość i zasięg ● LOD |
||
| 7 | Badanie stabilności |
● Długa - stabilność terminowa ● Przyspieszona stabilność ● Testy warunków skrajnych |
||
Zalety
| Zalety naszego systemu plazmidowego:
• Niezależnie opracowany system czterech - plazmidów z genem oporności Kanamycyny - • System o zdolności trwałej optymalizacji • Sekwencje plazmidowe są identyfikowalne, zgodne z wymaganiami i wydajne • Duże doświadczenie w udanych zgłoszeniach IND • Próbki komórek CAR - • 2 - 5 fałdów wyższych mian po użyciu naszego systemu plazmidu z porównania w kilku projektach |
Zalety naszej produkcji plazmidów: • Bez antybiotyków podczas procesu produkcyjnego • Produkcja plazmidu i tworzenie banków w osobnych warsztatach • Całkowita izolacja między obszarami nieheryalnymi i sterylnymi • Wydawanie produktów końcowych za pomocą izolatora • Ukończone dokumentacje CTD dla plazmidu opakowaniowego (dla wektora lentiwirusowego), skracając czas przygotowania do przesyłania o 3 - 4 miesiące, z INDS kilku produktów przyznanych wstępnym zatwierdzeniem i obecnie w fazie I badania klinicznego |
Proces produkcyjny
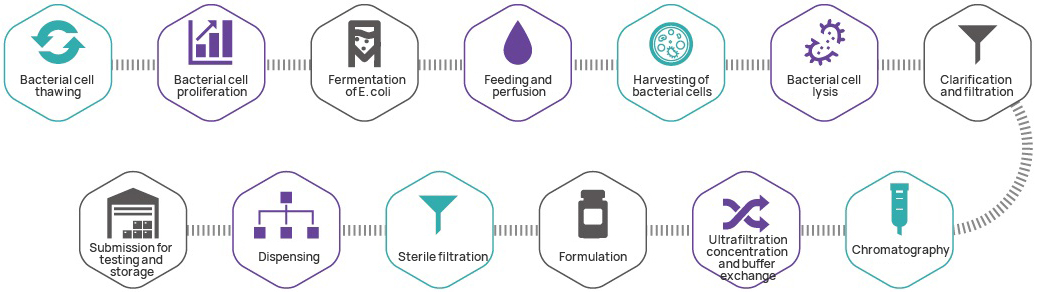
Kontrola jakości
| Przedmiot testowy | Metoda testowa | |
| Wygląd | Kontrola wzrokowa | |
| Identyfikacja | Identyfikacja 1 | Mapowanie ograniczeń |
| Identyfikacja 2 | Sekwencjonowanie Sanger | |
| Test | pH | Metoda 0631 CHP 2020 |
| Czystość | Wysoko wydajne chromatografia cieczowa (HPLC) | |
| Resztkowe białko komórek gospodarza E.Coli | Elisa | |
| Resztkowy DNA E.Coli | Q - PCR | |
| Resztkowy RNA E.Coli | Q - PCR | |
|
Resztkowe antybiotyki |
Elisa | |
| Endotoksyna | Metoda 1143 CHP 2020 | |
| Sterylność | Metoda 1101 CHP 2020 | |
| Określenie koncentracji | Stężenie DNA | Metoda 0401 CHP 2020 |
Oś czasu projektu
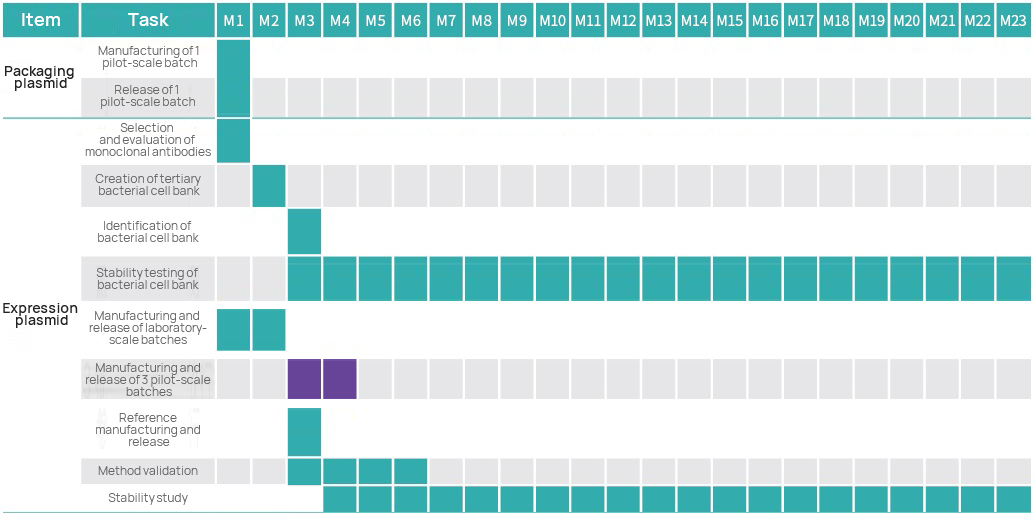
Plan zarządzania projektem
Zespół zarządzania projektami Hillgene, składający się z głównych naukowców, menedżerów projektów, ekspertów projektu QA i GMP, podejmie wysiłki w celu zapewnienia płynnego i solidnego działania każdego projektu GMP.













