Dịch vụ CDMO cho plasmid - Lớp lâm sàng
Dịch vụ
| Dịch vụ CDMO cho plasmid | ||||
| Loại | Dịch vụ | |||
| Lớp lâm sàng | 1 | GMP sản xuất plasmid |
● Đầu ra sản xuất: 10 mg ~ 1 g (tùy theo thay đổi tùy chỉnh) ● Khối lượng lên men: 3 ~ 30 L (tùy theo thay đổi tùy chỉnh) ● Phương pháp thanh lọc: Ba - Phương pháp tiếp cận/hai - Phương pháp tiếp cận bước |
● Toàn bộ - Hội thảo GMP ● Các hội thảo riêng biệt trong các khu vực không vô trùng và vô trùng ● Hệ thống quản lý chất lượng GMP ● Nhà máy, cơ sở và thiết bị được xác nhận tuân thủ các yêu cầu lâm sàng |
| 2 | Chuyển giao công nghệ |
● Chuyển giao công nghệ ● Nhận chuyển giao công nghệ |
● Vâng - Kế hoạch được thiết lập cho chuyển giao công nghệ ● Vâng - Kế hoạch được thiết lập để nhận chuyển giao công nghệ ● Lên kế hoạch chuyển giao các công nghệ khác nhau qua các giai đoạn khác nhau |
|
Thuận lợi
| Ưu điểm của hệ thống plasmid của chúng tôi:
• Một hệ thống bốn - plasmid được phát triển độc lập với kanamycin - gen kháng • Một hệ thống có khả năng tối ưu hóa bền vững • Trình tự plasmid có thể truy nguyên, tuân thủ các yêu cầu và hiệu quả • Trải nghiệm sâu rộng trong các bài nộp IND thành công • Các mẫu tế bào CAR - t để sử dụng lâm sàng hiện đang sản xuất và sử dụng • 2 - 5 gấp các chuẩn độ cao hơn sau khi sử dụng hệ thống plasmid của chúng tôi từ so sánh trong một số dự án |
Ưu điểm của sản xuất plasmid của chúng tôi: • Không có kháng sinh trong suốt quá trình sản xuất • Sản xuất plasmid và sáng tạo ngân hàng trong các hội thảo riêng biệt • Sự cô lập hoàn toàn giữa các vùng không vô trùng và vô trùng • Phân phối các sản phẩm cuối cùng bằng cách sử dụng bộ cách ly • Hồ sơ CTD đã hoàn thành cho plasmid đóng gói (đối với vectơ lentivirus), giảm thời gian chuẩn bị gửi xuống 3 - 4 tháng, với một vài sản phẩm được chấp thuận sơ bộ và hiện đang trong giai đoạn I của nghiên cứu lâm sàng |
Quá trình sản xuất
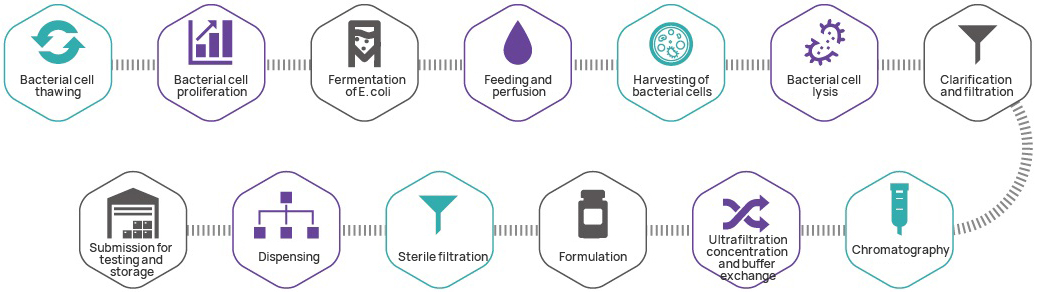
Kiểm soát chất lượng
| Mục kiểm tra | Phương pháp kiểm tra | |
| Vẻ bề ngoài | Kiểm tra trực quan | |
| Nhận dạng | Nhận dạng 1 | Lập bản đồ hạn chế |
| Nhận dạng 2 | Trình tự Sanger | |
| Bài kiểm tra | pH | Phương pháp 0631 của CHP 2020 |
| Sự thuần khiết | Sắc ký chất lỏng hiệu suất cao (HPLC) | |
| Protein tế bào chủ E.coli còn lại | ELISA | |
| DNA E.coli dư | Q - PCR | |
| RNA E.coli còn lại | Q - PCR | |
|
Kháng sinh còn lại |
ELISA | |
| Nội độc tố | Phương pháp 1143 của CHP 2020 | |
| Vô sinh | Phương pháp 1101 của CHP 2020 | |
| Xác định nồng độ | Nồng độ DNA | Phương pháp 0401 của CHP 2020 |
Dòng thời gian dự án
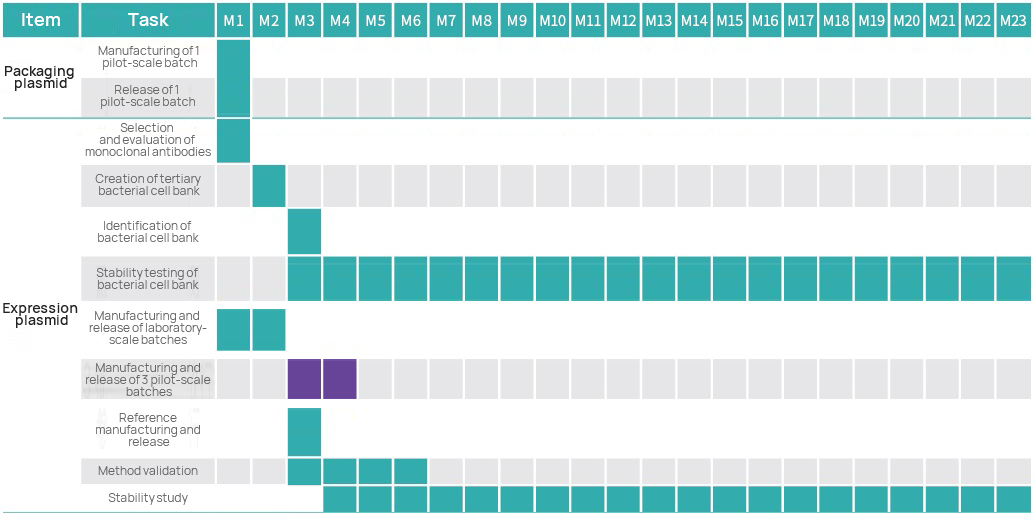
Kế hoạch quản lý dự án
Đội ngũ quản lý dự án Hillgene, bao gồm các nhà khoa học trưởng, quản lý dự án, các chuyên gia dự án QA và GMP, sẽ nỗ lực để đảm bảo hoạt động trơn tru và hợp lý của mỗi dự án GMP.













