Mga Serbisyo ng CDMO para sa Plasmids - Klinikal na Baitang
Mga Serbisyo
| Mga Serbisyo ng CDMO para sa Plasmids | ||||
| Mga uri | Mga Serbisyo | |||
| Klinikal na grado | 1 | Ang paggawa ng GMP ng mga plasmids |
● Output ng produksyon: 10 mg ~ 1 g (napapailalim sa mga pasadyang pagbabago) ● Dami ng pagbuburo: 3 ~ 30 L (napapailalim sa mga pasadyang pagbabago) ● Paraan ng paglilinis: Tatlong - Hakbang Diskarte/Dalawa - Diskarte sa Hakbang |
● Buong - GMP Workshop ● Paghiwalayin ang mga workshop sa loob ng hindi - sterile at sterile na mga lugar ● Sistema ng pamamahala ng kalidad ng GMP ● Napatunayan na halaman, pasilidad at kagamitan na sumusunod sa mga kinakailangan sa klinikal |
| 2 | Paglipat ng Teknolohiya |
● Paglipat ng teknolohiya ● Pagtanggap ng paglipat ng teknolohiya |
● Well - Itinatag na Plano para sa Paglipat ng Teknolohiya ● Well - itinatag na plano para sa pagtanggap ng paglipat ng teknolohiya ● Plano para sa paglilipat ng iba't ibang mga teknolohiya sa iba't ibang mga phase |
|
Kalamangan
| Mga kalamangan ng aming plasmid system:
• Isang malayang binuo ng apat na - plasmid system na may kanamycin - gene resistance • Isang sistema na may kakayahan ng matagal na pag -optimize • Ang mga pagkakasunud -sunod ng plasmid ay masusubaybayan, sumusunod sa mga kinakailangan, at mahusay • Malawak na karanasan sa matagumpay na pagsumite ng IND • Ang mga sample ng kotse - t cell para sa klinikal na paggamit ay kasalukuyang gumagawa at ginagamit • 2 - 5 folds mas mataas na titers pagkatapos gamitin ang aming plasmid system mula sa paghahambing sa maraming mga proyekto |
Mga kalamangan ng aming plasmid manufacturing: • Libre ng mga antibiotics sa buong proseso ng pagmamanupaktura • Ang paggawa ng plasmid at paglikha ng bangko sa magkahiwalay na mga workshop • Kumpletong paghihiwalay sa pagitan ng mga hindi - sterile at sterile na mga lugar • Dispensing panghuling produkto gamit ang isang isolator • Nakumpleto ang mga dossier ng CTD para sa packaging plasmid (para sa lentiviral vector), binabawasan ang oras ng paghahanda ng pagsusumite sa pamamagitan ng 3 - 4 na buwan, na may mga ind ng ilang mga produkto na binigyan ng paunang pag -apruba at kasalukuyang nasa phase I ng klinikal na pag -aaral |
Proseso ng Paggawa
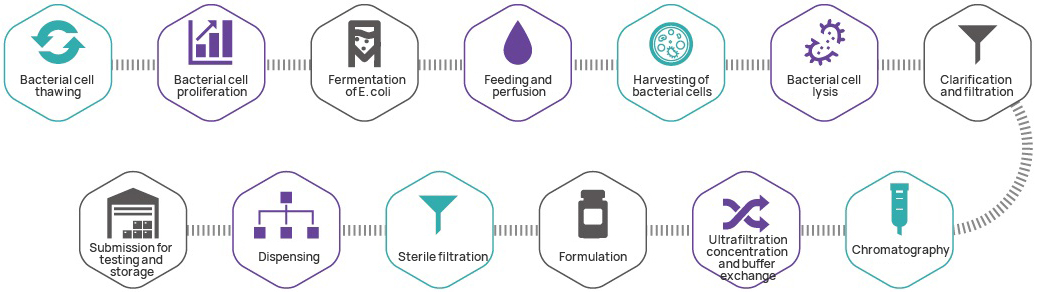
KONTROL CONTROL
| Pagsubok ng item | Paraan ng Pagsubok | |
| Hitsura | Visual inspeksyon | |
| Pagkakakilanlan | Pagkilala 1 | Pagtatakda ng Pagtatakda |
| Pagkilala 2 | Sequencing ng Sanger | |
| Pagsubok | pH | Paraan 0631 ng CHP 2020 |
| Kadalisayan | Mataas na Pagganap ng Liquid Chromatography (HPLC) | |
| Residual E.Coli Host Cell Protein | Elisa | |
| Residual E.Coli DNA | q - pcr | |
| Residual E.coli RNA | q - pcr | |
|
Residual antibiotics |
Elisa | |
| Endotoxin | Paraan 1143 ng CHP 2020 | |
| Sterility | Paraan 1101 ng CHP 2020 | |
| Pagpapasiya ng konsentrasyon | Konsentrasyon ng DNA | Paraan 0401 ng CHP 2020 |
Timeline ng proyekto
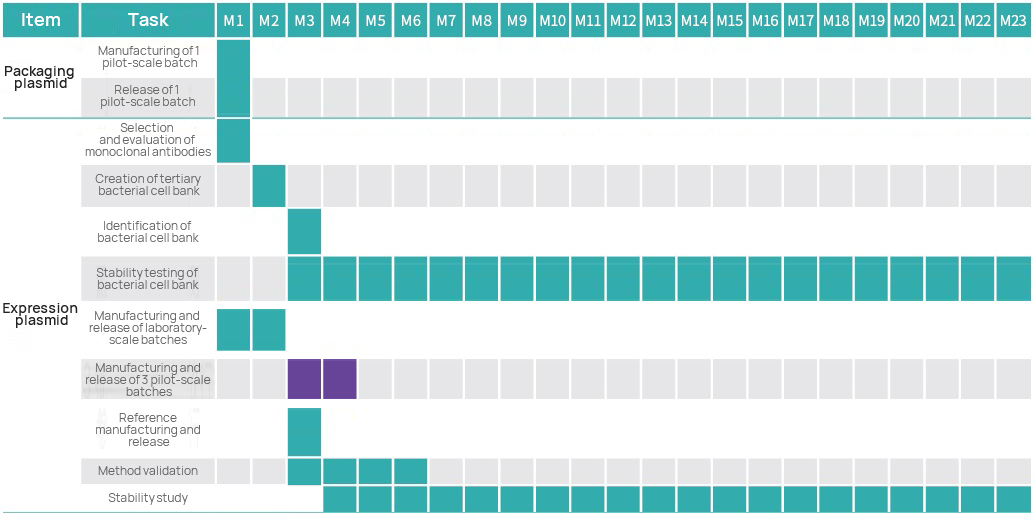
Plano ng Pamamahala ng Proyekto
Ang koponan ng pamamahala ng proyekto ng Hillgene, na binubuo ng mga punong siyentipiko, tagapamahala ng proyekto, mga eksperto sa proyekto ng QA at GMP, ay magsisikap upang matiyak ang maayos at maayos na operasyon ng bawat proyekto ng GMP.













