บริการ CDMO สำหรับเวกเตอร์ lentiviral - เกรดเชิงพาณิชย์
บริการ
| บริการ CDMO สำหรับเวกเตอร์ lentiviral (แพลตฟอร์มHilenti®) | ||||
| ประเภท | บริการ | |||
| เกรดเชิงพาณิชย์ | 1 | การผลิต GMP ของเวกเตอร์ lentiviral |
●กระบวนการเครื่องปฏิกรณ์ชีวภาพ: 5 ~ 50 L กระบวนการเครื่องปฏิกรณ์ชีวภาพแบบใช้แล้วทิ้ง (ขึ้นอยู่กับการเปลี่ยนแปลงที่กำหนดเอง) ●ระดับการผลิต: 2 ~ 30 L (ขึ้นอยู่กับการเปลี่ยนแปลงที่กำหนดเอง) |
/ |
ข้อดี
| ข้อดีของการใช้แพลตฟอร์มของเราสำหรับเซรั่ม - การเพาะเลี้ยงการระงับฟรีของเวกเตอร์ lentiviral:
•ปราศจากสัตว์ - ส่วนประกอบที่ได้รับตลอดกระบวนการ •ปรับขนาดเชิงเส้นขึ้นของการผลิตเวกเตอร์ lentiviral •ใช้ภาชนะเดียวของเครื่องปฏิกรณ์ชีวภาพแบบใช้แล้วทิ้ง 50 ลิตร •การสร้างธนาคารเซลล์ในการประชุมเชิงปฏิบัติการแยกต่างหาก •จ่ายผลิตภัณฑ์ขั้นสุดท้ายโดยใช้ตัวแยกที่ผ่านการฆ่าเชื้อแล้ว •ระบบ lentivirus เฉพาะสำหรับรถยนต์ - T เซลล์ที่มีประสิทธิภาพการติดเชื้อสูง •ต้นทุนการผลิตต่ำและต้นทุนการทดสอบ (ไม่มีข้อกำหนดของการทดสอบสำหรับ BSA และเอนไซม์ตับอ่อนที่เหลืออยู่) •การส่ง IND ที่ประสบความสำเร็จหลายครั้งไปยัง NMPA ของเวกเตอร์ lentiviral สำหรับรถยนต์ - T เซลล์ |
กระบวนการผลิต

การควบคุมคุณภาพ
| ผลิตภัณฑ์ | รายการทดสอบ | วิธีทดสอบ |
| ของเหลวเก็บเกี่ยว | การปนเปื้อนของไวรัส | วิธี 3302 ของ CHP 2020 |
| การจำลองแบบ - lentiviruses ที่มีความสามารถ | วิธีการเพาะเลี้ยงเซลล์ตัวบ่งชี้ | |
| สารเสพติด/ผลิตภัณฑ์สำเร็จรูป | รูปร่าง | การตรวจสอบภาพ |
| การทำให้หมัน | วิธีการ 1101 ของ CHP 2020 | |
| Mycoplasma |
วิธี 3301 ของ CHP 2020 |
|
| pH | วิธี 0631 ของ CHP 2020 | |
| ความผิดปกติ | วิธี 0632 ของ CHP 2020 | |
| การระบุโครงสร้างของยีนเป้าหมาย | การเรียงลำดับ | |
| โปรตีนเซลล์โฮสต์ที่เหลืออยู่ | เอลิซา | |
| titer ทางกายภาพ (p24) | เอลิซา | |
| titer ที่ใช้งานได้ | โฟลว์ไซโตเมทรี | |
| เอนโดท็อกซิน | วิธีการ 1143 ของ CHP 2020 | |
| เบนโซเนสที่เหลืออยู่ | เอลิซา | |
| DNA เซลล์โฮสต์ที่เหลืออยู่ | Q - PCR | |
| การถ่ายโอนยีน E1A ที่เหลืออยู่ | CO - วิธีการทางวัฒนธรรม | |
| การถ่ายโอนยีน SV40 ที่เหลืออยู่ | CO - วิธีการทางวัฒนธรรม |
ไทม์ไลน์โครงการ
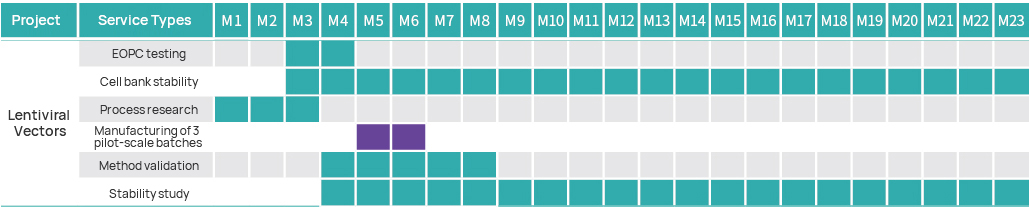
แผนการจัดการโครงการ
ทีมผู้บริหารโครงการ Hillgene ซึ่งประกอบด้วยหัวหน้านักวิทยาศาสตร์ผู้จัดการโครงการผู้เชี่ยวชาญด้านโครงการ QA และ GMP จะพยายามอย่างเต็มที่เพื่อให้แน่ใจว่าการดำเนินงานที่ราบรื่นและดีของโครงการ GMP ทุกโครงการ













