A necesidade de probas de ADN residual de E.coli
En campos como a terapia celular e xénica, os plásmidos virais amplifícanse e fermentan usando E. coli como hóspede. O plásmido amplificado necesita sufrir un control de calidade do ADN residual de E.Coli antes de que se poida usar para infectar 293 células e embalar o virus. Polo tanto, a detección de ADN residual de E.coli é fundamental.
Requisitos regulatorios e métodos de proba
As directrices actuais da OMS e dos Estados Unidos recomendan o ADN residual en produtos acabados para non ser superior a 10 ng/axente, e a FDA dos Estados Unidos tamén afirma que o ADN residual nas células hóspede dos biolóxicos non debe ser superior a 100 pg/axente. Os principios xerais da farmacopea europea estipula que o límite do ADN residual nos produtos biolóxicos non debería ser superior a 10 ng/dose, pero o límite de ADN residual para algunhas vacinas particulares é máis rigoroso, por exemplo, o ADN residual na vacina inactivada contra a hepatitis A non debería ser superior a 100 PG/Dose, e a vacina contra a vacina contra o hepatitis A contra o hepatitis A. PG/dose. A edición de 2020 da farmacopea chinesa, a parte III, estipula que o residuo de ADN nas preparacións biolóxicas producidas nunha matriz celular non debe exceder os 100 pg/dose, e o residuo de ADN nas vacinas producidas nunha matriz bacteriana ou fungos non debería exceder 10 ng/dose.
Ademais, para os métodos de determinación de residuos de ADN exóxeno, as farmacopeo nacionais tamén dan recomendacións de orientación. A edición de Farmacopea 2017 dos Estados Unidos de USP40 - NF35 Disposición xeral 1130 describe tres métodos para a determinación de residuos de ADN exóxenos, que son hibridación de sonda de ADN, método de limiar e método de PCR cuantitativo en tempo. A farmacopea europea propón reais - PCR cuantitativa de tempo e método inmunoenzimático, dous métodos analíticos sensibles para cuantificar o ADN residual das células hóspede. A versión de farmacopea chinesa 2020 das tres regras xerais 3407 tamén estipula que os métodos de detección de residuos de ADN das células hóspede son a hibridación da sonda de ADN, a tinción de fluorescencia e a PCR cuantitativa.
Entre eles, o método QPCR ten unha sensibilidade extremadamente alta, especificidade e precisión da secuencia, o que pode proporcionar un medio fiable de detección para a industria biofarmacéutica na investigación de procesos e o control de calidade dos produtos acabados, e agora converteuse no método de detección preferido para cada fabricante de biolóxicos.
Información sobre produtos BlueKit
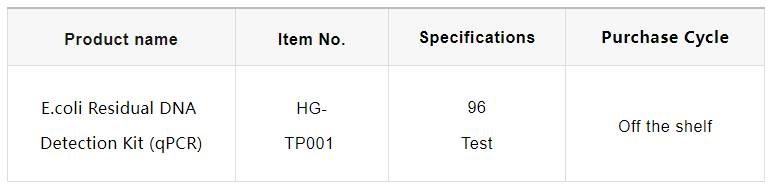
Características do produto
A detección rápida, unha forte especificidade, o rendemento fiable, o límite de detección máis baixo pode alcanzar o nivel de "FG".
Parámetros do produto
- Rango de detección: 3,00 × 101 ~ 3,00 × 105fg/µl
- Límite de cuantificación :00 × 101fg/µl
- Límite de detección :00 FG/μL
- Precisión: CV% ≤ 15%.
Problemas e precaucións de detección comúns
1. Este kit é só para un uso de investigación in vitro, non para o diagnóstico clínico.
2. O kit debe usarse dentro do período de validez.
3. Todos os compoñentes do kit recoméndanse derreter nun ambiente de baixa temperatura e logo usado.
4. Só cumprir estrictamente as instrucións do método de operación, todo o uso dos reactivos de apoio ao kit para garantir o mellor efecto de detección.
5. Preste atención aos diferentes pasos de mostraxe en tempo e forma para substituír a punta, para evitar a contaminación cruzada, evite abrir a tapa durante moito tempo.
6. Os resultados finais da proba poden verse afectados significativamente pola eficacia dos reactivos, os métodos de funcionamento do operador e o ambiente de proba.
Consulta do produto
Teléfono: +86 - 18013115357
Correo electrónico:info@hillgene.com
Tempo de publicación: 2024 - 01 - 11 10:31:30











